
手機(jī)掃碼訪問本站

微信咨詢
在所有分子生物學(xué)領(lǐng)域中,用于核酸(DNA、RNA)定量的首選方法是實(shí)時(shí)熒光定量PCR(QuantitativeReal-timePCR,qPCR)。它能實(shí)時(shí)監(jiān)測聚合酶鏈?zhǔn)椒磻?yīng)(PCR)擴(kuò)增DNA的事實(shí)。與傳統(tǒng)PCR相比,它是一種定量方法,它能夠確定樣本中擴(kuò)增DNA的精確量(相對或絕對)。相反,在傳統(tǒng)PCR中,擴(kuò)增的DNA只能在擴(kuò)增完成后才能檢測到(終點(diǎn)檢測)。
除了DNA,RNA也可用作模板(例如,在基因表達(dá)研究或RNA病毒檢測中)。在這種情況下,需要將RNA逆轉(zhuǎn)錄為DNA(也稱為互補(bǔ)DNA或cDNA),然后使用實(shí)時(shí)PCR進(jìn)行擴(kuò)增。這種組合方法有一個(gè)術(shù)語:實(shí)時(shí)逆轉(zhuǎn)錄PCR或簡稱為qRT-PCR(有時(shí)稱為RT-qPCR)。
PCR是一種利用酶(熱穩(wěn)定DNA聚合酶,最初于20世紀(jì)60年代從美國黃石公園熱湖中生長的水生棲熱菌中分離出來的)循環(huán)擴(kuò)增模板DNA的短片段(擴(kuò)增子)的方法。在每個(gè)循環(huán)中,DNA的短片段數(shù)量都會翻倍,從而導(dǎo)致目標(biāo)呈指數(shù)級擴(kuò)增。
在qPCR中,發(fā)生的程序完全相同,但有兩個(gè)主要區(qū)別:首先,擴(kuò)增的DNA是熒光標(biāo)記的(通常使用基于花菁的熒光染料),其次,擴(kuò)增過程中釋放的熒光量與擴(kuò)增的DNA量成正比。整個(gè)PCR過程(以及所有30至45個(gè)循環(huán))都會監(jiān)測熒光。樣本中DNA分子的初始數(shù)量越多,PCR循環(huán)中熒光增加的速度就越快(圖1和2)。也就是說如果樣本包含較多靶標(biāo),則可以在較早的循環(huán)中檢測到熒光。可以檢測到熒光的循環(huán)稱為定量循環(huán)(簡稱Cq),是qPCR的基本結(jié)果:Cq值越低,意味著靶標(biāo)的初始拷貝數(shù)越高。這是實(shí)時(shí)PCR提供的定量方法的基本原理。
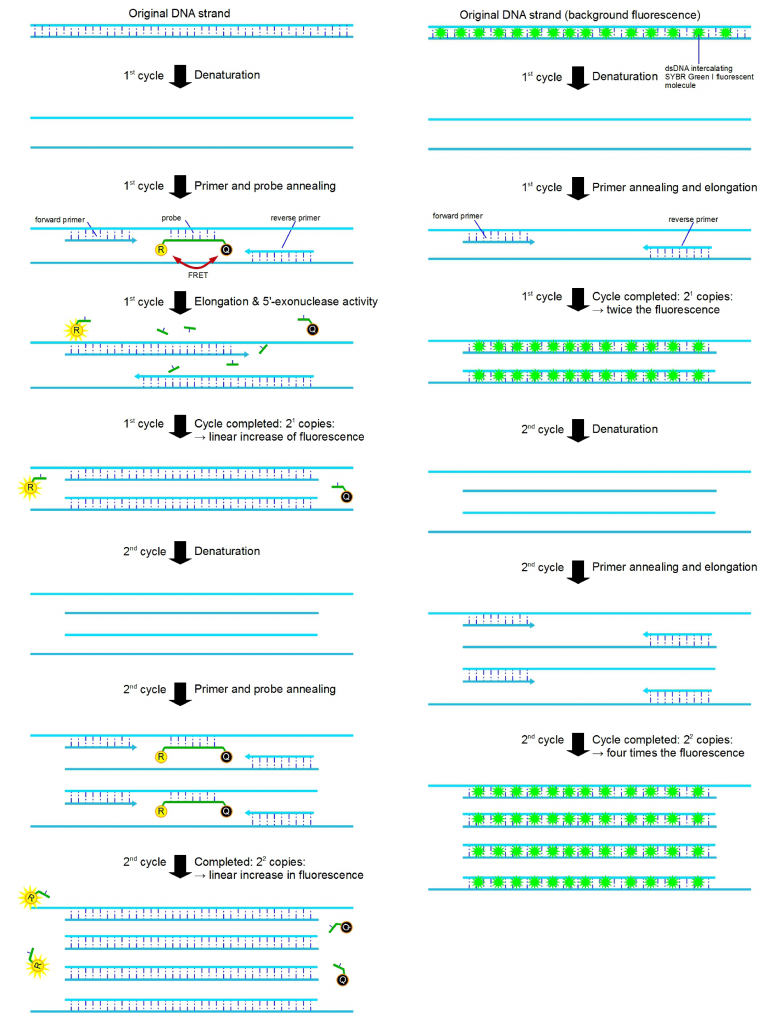
圖 1:以圖形方式描述了 PCR 管中發(fā)生的 qPCR 擴(kuò)增(前兩個(gè)循環(huán))。qPCR 信號分子(也稱為化學(xué)物質(zhì))有不同的變體,它們的熒光標(biāo)記方式略有不同。圖中顯示了兩種最常見的原理。左側(cè)顯示的是使用 FRET 機(jī)制(熒光共振能量轉(zhuǎn)移)的 5′-核酸外切酶變體,其中報(bào)告熒光團(tuán) (R) 的熒光被轉(zhuǎn)移到猝滅劑 (Q),并且當(dāng)報(bào)告分子和猝滅劑分子接近時(shí)不會發(fā)射熒光(例如 TaqMan)。當(dāng)兩者錯位時(shí)(當(dāng)探針在 PCR 延伸過程中被 TaqDNA 聚合酶的 5′-核酸外切酶活性移除時(shí)),報(bào)告分子會自由發(fā)射熒光,然后可以檢測到。右側(cè)顯示的是使用插入熒光團(tuán)的 qPCR 變體(例如 SYBR Green)。使用特殊的插入染料,當(dāng)它們插入 dsDNA 中時(shí),熒光發(fā)射會大大增加。
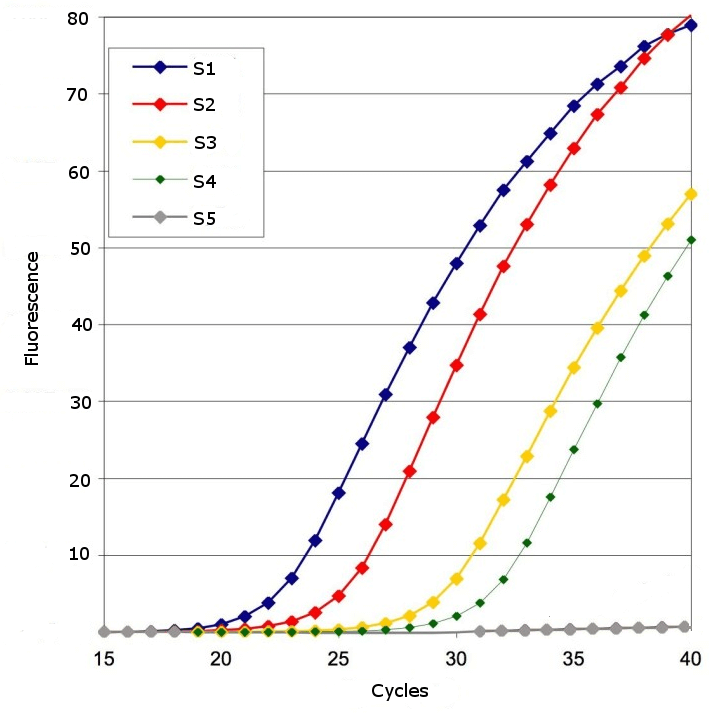
圖 2:顯示包含五個(gè)樣本(S1 至 S5)的擴(kuò)增圖。每個(gè)樣本中的 DNA 在每個(gè)循環(huán)中都被擴(kuò)增,熒光隨之增加。在上面的例子中,樣本 S1 包含的初始目標(biāo) DNA 數(shù)量最多,因此熒光增加最快。樣本 S4 包含的初始目標(biāo) DNA 分子數(shù)量最少,而 S5 則不包含任何目標(biāo) DNA 分子。
有幾種方法可以獲得Cq值(Cq調(diào)用)、我們應(yīng)該定期檢查的擴(kuò)增曲線參數(shù)、將Cq值轉(zhuǎn)換為基因表達(dá)的絕對或相對拷貝數(shù)的方法等。一旦掌握了這些技能,qPCR就會成為您研究中真正強(qiáng)大的技術(shù)。
擴(kuò)增的DNA有多種熒光標(biāo)記方法(也稱為“qPCR化學(xué)方法”),但我們在此不作詳細(xì)討論。它們都有一個(gè)共同點(diǎn):在PCR反應(yīng)過程中產(chǎn)生熒光信號,該信號是可量化的,并且與DNA的起始量成正比。
優(yōu)于傳統(tǒng)PCR:
1.速度:擴(kuò)增的DNA在PCR反應(yīng)的同時(shí)進(jìn)行檢測,因此無需像傳統(tǒng)PCR那樣在反應(yīng)后進(jìn)行單獨(dú)檢測(例如在瓊脂糖凝膠上)。
2.通量:qPCR被認(rèn)為是一種高通量方法(在短時(shí)間內(nèi)處理大量樣品),因?yàn)樗c用于樣品制備的液體處理自動化站兼容(DNA/RNA分離和加載到qPCR板上)。
3.靈敏度:qPCR可以區(qū)分2倍大小的目標(biāo)DNA分子,甚至可以檢測到少量的起始DNA分子,與PCR相比,使用量僅為1/1000。
4.定量范圍:可進(jìn)行幾個(gè)數(shù)量級的廣泛定量(動態(tài)范圍高達(dá)107倍)。
5.可重復(fù)性:一般認(rèn)為具有高度可重復(fù)性。
qPCR的缺點(diǎn):
1.設(shè)備成本:由于敏感熒光檢測所需的光學(xué)元件,qPCR循環(huán)儀比傳統(tǒng)PCR熱循環(huán)儀貴五到十倍。
2.化學(xué)品和耗材成本:qPCR是一種非常靈敏的方法,因此,反應(yīng)混合物的精確成分和高質(zhì)量極其重要。這就是為什么通常購買即用型反應(yīng)混合物(主混合物)的原因。由于檢測方法(熒光)靈敏,因此需要一套特定的塑料器皿。
3.上樣時(shí)間:與傳統(tǒng)PCR相比,將qPCR樣品上樣到板中通常是一個(gè)更加精確和繁瑣的過程,這主要是因?yàn)槭褂玫脑噭┖蜆悠窋?shù)量更多,而且該方法的靈敏度極高。但是,如果使用PlatR等移液輔助器,上樣時(shí)間可以大大縮短。
4.PCR反應(yīng)抑制:由于生物樣本的復(fù)雜性,核酸分離過程中不完善的純化過程可能會在分離的樣本中留下各種物質(zhì)的痕跡。PCR反應(yīng)有時(shí)會被這些物質(zhì)抑制,也稱為PCR反應(yīng)抑制劑(DNA聚合酶易受某些抑制其活性的化合物的影響)。這會使定量過程復(fù)雜化。
5.誤差敏感性:qPCR是一種極其敏感的方法,因此很容易出錯。這意味著即使是最輕微的錯誤也會對最終結(jié)果產(chǎn)生重大影響。最易變和最關(guān)鍵的一點(diǎn)是樣品的制備(DNA提取和逆轉(zhuǎn)錄)。這就是為什么在進(jìn)行測定時(shí)需要包括幾個(gè)控制反應(yīng)(例如無模板控制、緩沖液控制)以確保每次運(yùn)行的質(zhì)量控制檢查。
6.數(shù)據(jù)分析:數(shù)據(jù)分析和結(jié)果解釋比傳統(tǒng)PCR更復(fù)雜,但結(jié)果更具信息量。
由于其強(qiáng)大的優(yōu)勢,qPCR的應(yīng)用范圍非常廣泛。該方法已經(jīng)存在了很長時(shí)間,研究界已經(jīng)證明了它的可靠性和穩(wěn)健性。同樣,qPCR循環(huán)儀制造商開發(fā)了可靠的平臺,液體處理自動化設(shè)備供應(yīng)商開發(fā)了與qPCR兼容的自動化解決方案(例如機(jī)器人)。
最明顯的是qPCR在分子診斷中的應(yīng)用,它正在慢慢取代傳統(tǒng)方法。它用于檢測、鑒定和量化導(dǎo)致疾病的微生物(細(xì)菌、病毒和真菌)。使用qPCR可以減少手工勞動,同時(shí)還可以減少對污染和錯誤結(jié)果的擔(dān)憂。它還可以在更短的時(shí)間內(nèi)處理大量樣本(每次運(yùn)行最多384個(gè)甚至1536個(gè)反應(yīng)),因此已被證明是診斷實(shí)驗(yàn)室中不可替代的方法。但必須注意的是,該方法僅檢測微生物DNA或RNA的存在,而不會報(bào)告其活力。因此,有時(shí)仍需要同時(shí)使用傳統(tǒng)的微生物技術(shù)。
qPCR還用于檢測和量化轉(zhuǎn)基因生物或進(jìn)行基因分型。后者意味著可以檢測同一基因的不同等位基因或單核苷酸多態(tài)性(SNP),這些可用作某些疾病的遺傳診斷或預(yù)后標(biāo)記。
基因表達(dá)研究是非常重要的應(yīng)用領(lǐng)域,它幫助我們了解生物學(xué)、微生物學(xué)、醫(yī)學(xué)和其他生命科學(xué)等各個(gè)領(lǐng)域的生物過程。一種非常有用、幾乎轟動一時(shí)的組合是使用DNA微陣列進(jìn)行全基因組基因表達(dá)篩選,然后使用qPCR驗(yàn)證結(jié)果。DNA微陣列本身就是一種非常有效的方法,但它們的靈敏度較低,仍然需要驗(yàn)證。
 QQ:2881498722
QQ:2881498722  手機(jī)號碼:15800441226
手機(jī)號碼:15800441226 服務(wù)電話:021-54721350
服務(wù)電話:021-54721350 E-mail:2881498722@qq.com
E-mail:2881498722@qq.com 公司地址:上海市金山工業(yè)區(qū)亭衛(wèi)公路6558號9幢2447-12室
公司地址:上海市金山工業(yè)區(qū)亭衛(wèi)公路6558號9幢2447-12室