
手機(jī)掃碼訪問本站

微信咨詢
衣康酸(itaconate)是免疫過程中代謝重編后的最好例子之一。它是由三羧酸循環(huán)(TCA循環(huán))中的順勢烏頭酸(cis-aconitate)在巨噬細(xì)胞中合成的,巨噬細(xì)胞被多種因素激活,尤其是脂多糖(LPS),以及其他Toll樣受體(TLR)配體和細(xì)胞因子,如I型和II型干擾素[1-4],這些刺激增加了烏頭酸脫羧酶1 (ACOD1;也被稱為CAD),最初叫免疫響應(yīng)基因1蛋白質(zhì)(IRG1),順式烏頭酸從TCA循環(huán)中轉(zhuǎn)移,重新調(diào)整其用途以產(chǎn)生衣康酸(圖1)。目前的研究表明,衣康酸是一種重要的免疫代謝產(chǎn)物,對免疫、宿主防御和腫瘤發(fā)生具有深遠(yuǎn)的影響。
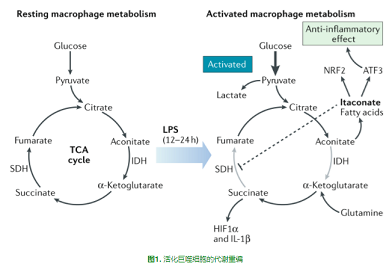
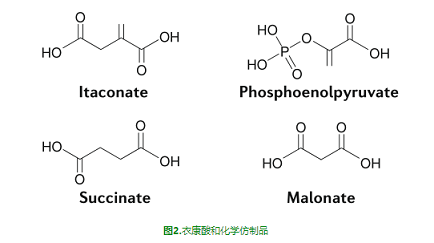
IRG1已被證明定位于線粒體[5],這是巨噬細(xì)胞活化過程中活躍的代謝重構(gòu)位點(diǎn)。在促炎觸發(fā)后,巨噬細(xì)胞向糖酵解表型轉(zhuǎn)變,而線粒體功能則隨著耗氧量的降低而下降[6]。線粒體功能障礙是TCA循環(huán)中兩個斷點(diǎn)的結(jié)果,這兩個斷點(diǎn)使線粒體功能喪失[7]。突變點(diǎn)與琥珀酸(succinate)的積累[8]和通過異檸檬酸(isocitrate)脫氫酶阻斷代謝通量有關(guān)[7]。通過琥珀酸脫氫合酶(SDH)進(jìn)行的琥珀酸氧化可以在復(fù)合物I處進(jìn)行反向電子輸運(yùn),從而驅(qū)動活性氧物質(zhì)(ROS)的生成以促進(jìn)缺氧誘導(dǎo)因子1α(HIF1α)和IL-1β的生成[8]。IRG1介導(dǎo)的衣康酸積累在巨噬細(xì)胞的促炎性激活過程中引起琥珀酸積累[9-10]。衣康酸能直接抑制來源于原代巨噬細(xì)胞的SDH的酶活性。衣康酸直接抑制SDH的能力來源于其與琥珀酸的結(jié)構(gòu)相似性(圖2),衣康酸和經(jīng)典的SDH抑制劑丙二酸(malonate),可以競爭性地阻斷SDH活性位點(diǎn)[11]。
衣康酸鹽抑制SDH的能力是衣康酸鹽的一個顯著的代謝調(diào)節(jié)特征,表明衣康酸鹽在缺乏IRG1的巨噬細(xì)胞中的免疫調(diào)節(jié)作用可能部分歸因于這種抑制作用。
NRF 2最初被認(rèn)為是氧化應(yīng)激的傳感器,它被一種叫做Kelch-like ECH相關(guān)蛋白1(Keap1)的蛋白質(zhì)所控制,這種蛋白質(zhì)以NRF 2為靶點(diǎn),用于蛋白質(zhì)體降解[12]。然而,在氧化應(yīng)激反應(yīng)中,KEAP1被滅活,NRF2被釋放,誘導(dǎo)大量NRF2依賴基因的轉(zhuǎn)錄。由此產(chǎn)生的基因產(chǎn)物在很大程度上保護(hù)了應(yīng)激誘導(dǎo)的細(xì)胞死亡,特別是氧化應(yīng)激的細(xì)胞毒性作用。NRF2被認(rèn)為是感染和炎癥過程中損傷的關(guān)鍵控制因子[13]。這種控制的發(fā)生是因為它能夠增加編碼酶的基因的表達(dá),如血紅素加氧酶1和參與合成谷胱甘肽(glutathione)的酶,谷胱甘肽是防止細(xì)胞氧化應(yīng)激的主要保護(hù)劑。
這些發(fā)現(xiàn)使NRF2成為一種新的抗炎方法的有吸引力的靶點(diǎn)。衣康酸的兩個衍生物,2-甲基衣康酸和4-辛基衣康酸均具有細(xì)胞滲透性,能激活NRF2并在巨噬細(xì)胞中驅(qū)動NRF2依賴性基因表達(dá)[14-15]。衣康酸激活NRF2除了誘導(dǎo)NRF2依賴基因外,還會產(chǎn)生下游效應(yīng)。衣康酸抑制IL-1β誘導(dǎo)的能力包括抑制SDH(如上所述),但也在一定程度上涉及Nrf2的激活[15]。這可能是由于NRF2直接抑制IL1B基因轉(zhuǎn)錄,也可能是通過誘導(dǎo)抗氧化劑(如谷胱甘肽)產(chǎn)生的,谷胱甘肽會限制ROS,這已被證明是誘導(dǎo)IL-1β所必需的[16]。
因此,總的來說,衣康酸對NRF2的作用將通過誘導(dǎo)抗炎基因(如編碼血氧合酶1的基因)來控制炎癥,這些基因通過升高的谷胱甘肽來限制ROS的炎癥作用,也可能直接阻斷促炎基因的轉(zhuǎn)錄。圖3描述了衣康酸作為半胱氨酸(cysteine)修飾劑在靶蛋白上的作用,這些修飾可能導(dǎo)致免疫功能的改變。
圖3. 衣康酸可修飾蛋白質(zhì)以引起抗炎作用.
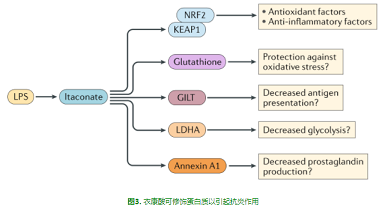
作為一種α,β-不飽和羧酸,衣康酸有一個經(jīng)典的親電骨架,允許它接受來自被稱為親核細(xì)胞的潛在相互作用伙伴的電子對。在細(xì)胞環(huán)境中,親電化合物通常以含有巰基(–SH)基團(tuán)的蛋白質(zhì)為目標(biāo),從而誘導(dǎo)親電應(yīng)激反應(yīng)(ESR)。谷胱甘肽是細(xì)胞中最普遍存在的分子之一,它通過中和細(xì)胞中多余的親電體,然后分泌谷胱甘肽親電加合物,提供了對抗親電應(yīng)激的第一線防御。例如,直接質(zhì)譜測定表明,內(nèi)源性衣康酸與谷胱甘肽形成加合物[14]。ESR通常由KEAP1通過其反應(yīng)性半胱氨酸殘基檢測到,使其類似于氧化應(yīng)激反應(yīng)。雖然KEAP1-NRF2被認(rèn)為是ESRs的主要調(diào)控因子,但幾個KEAP1獨(dú)立或NRF2獨(dú)立的通路也被親電應(yīng)激觸發(fā):熱休克反應(yīng)、自噬溶酶體通路和內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)[17]。這些途徑受許多調(diào)節(jié)因子控制,包括ATF3、AF4、p62和熱休克因子蛋白1[17]。因此,ESR是由這些途徑的激活程度來定義的,幾乎每個親電分子在激活ESR成分時都有一個獨(dú)特的足跡。
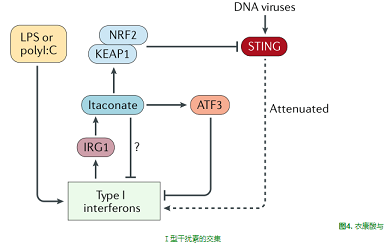
衣康酸及其衍生物為研究ESR譜提供了獨(dú)特的機(jī)會。在缺乏IRG1的巨噬細(xì)胞中的實(shí)驗表明,內(nèi)源性衣康酸除了NRF2激活外,還可以誘導(dǎo)ATf3蛋白和ATf3驅(qū)動的應(yīng)激反應(yīng)[14]。ATF3是一種免疫激活的全球性負(fù)調(diào)節(jié)因子,可以調(diào)節(jié)IL-6等細(xì)胞因子[18],也是與線粒體應(yīng)激相關(guān)的主要調(diào)節(jié)因子[19],在代謝紊亂和炎癥信號之間提供了額外的聯(lián)系。
最近研究表明,NRF2可抑制干擾素基因(STING)的刺激因子,后者是病毒感染期間I型干擾素產(chǎn)生的關(guān)鍵驅(qū)動因素,4-辛基-衣康酸可抑制STING,并抑制Ⅰ型干擾素在對STING活化劑和病毒的應(yīng)答中的表達(dá)[20]。4-辛基-衣康酸的作用依賴于NRF2,因為4-辛基-衣康酸不能阻斷NRF2缺陷細(xì)胞中的STING。4-辛基-衣康酸還抑制了嬰兒期發(fā)病的被稱為STING相關(guān)血管病變的患者的成纖維細(xì)胞產(chǎn)生Ⅰ型干擾素,這些患者在編碼STING的基因第5外顯子中有功能點(diǎn)突變。4-辛基-衣康酸也被證明能有效地阻斷脂多糖或聚肌苷-聚胞苷酸(polyⅠ:C)誘導(dǎo)的Ⅰ型干擾素[15],進(jìn)一步表明Ⅰ型干擾素的產(chǎn)生可能是衣康酸一個特別重要的靶點(diǎn)。內(nèi)源性衣康酸參與調(diào)節(jié)干擾素信號的作用和確切機(jī)制尚待確定。衣康酸與I型干擾素的交叉點(diǎn)如圖4所示。
防止炎癥巨噬細(xì)胞(也稱為M2巨噬細(xì)胞)分化將增加IRG1的表達(dá)和衣康酸的產(chǎn)生[21-22]。過氧化物酶體增殖物激活受體γ(PPARγ)是脂肪生成和脂肪細(xì)胞功能的主要調(diào)節(jié)因子,已被證實(shí)參與了M2巨噬細(xì)胞的激活。PPARγ被證明是IL-4依賴基因表達(dá)所必需的,PPARγ缺乏導(dǎo)致IRG1表達(dá)增強(qiáng)[21]。有可能,去除炎癥巨噬細(xì)胞誘導(dǎo)的制動器(PPARγ形式)導(dǎo)致衣康酸的補(bǔ)償性增加,以恢復(fù)體內(nèi)平衡。圖5a所示的IRG1和衣康酸在M2巨噬細(xì)胞極化中的可能作用。
衣康酸在另一個巨噬細(xì)胞群——腫瘤相關(guān)巨噬細(xì)胞中的作用,被認(rèn)為與M2巨噬細(xì)胞有點(diǎn)類似[23]。在涉及B16黑色素瘤細(xì)胞或ID8卵巢癌細(xì)胞的腹膜腫瘤中,一種無偏倚的代謝組學(xué)篩選鑒定出,衣康酸是腹膜組織駐留巨噬細(xì)胞中高度上調(diào)的代謝產(chǎn)物之一。IRG1基因的敲除顯著減少了腹腔腫瘤的發(fā)生,表明衣康酸具有促腫瘤作用。其機(jī)制似乎與衣康酸促進(jìn)氧化磷酸化有關(guān),而氧化磷酸化反過來又會增加ROS的產(chǎn)生,從而增加腫瘤的生長。圖5b顯示了腫瘤相關(guān)巨噬細(xì)胞產(chǎn)生的衣康酸作為腫瘤前代謝物的可能作用。
衣康酸可以驅(qū)動人類單核細(xì)胞的先天免疫耐受(即對炎癥刺激的反應(yīng)降低)[24]。β-葡聚糖是一種真菌細(xì)胞壁成分,已知能長期上調(diào)單核細(xì)胞固有免疫功能,通過降低IRG1的表達(dá)來抵消耐受性。β-葡聚糖也增加了SDH的表達(dá),促進(jìn)氧化磷酸化。重要的是,編碼IRG1和SDH的基因多態(tài)性被描述為調(diào)節(jié)耐受性的誘導(dǎo)。衣康酸在巨噬細(xì)胞免疫麻痹中的作用如圖5c所示。
對于一種在19世紀(jì)首次被描述,然后在哺乳動物系統(tǒng)中被忽視的代謝物,過去幾年里,人們對衣康酸的興趣有了顯著的提高。對衣康酸免疫作用的研究已經(jīng)表明了治療多種疾病的可能性。以SDH為中心和親電方式的衣康酸作用均表明衣康酸具有明顯的抗炎活性。衣康酸或其衍生物修飾多種炎癥蛋白,包括NRF2和ATF3,表明衣康酸在多種疾病中可能具有治療潛力。其與腫瘤生長、M2巨噬細(xì)胞功能、免疫麻痹的聯(lián)系,都為進(jìn)一步分析衣康酸在健康和疾病中的作用提供了誘人的前景。
中科脂典(中科院遺傳發(fā)育所參股孵化)是一家主要從事前沿生物技術(shù)開發(fā)、生物技術(shù)服務(wù)、生物制品研發(fā)及銷售的高科技公司。公司在脂組學(xué)、代謝組學(xué)、蛋白組學(xué)等領(lǐng)域開發(fā)了具有國際前沿水平的組學(xué)技術(shù)。公司提供基于液相色譜連接質(zhì)譜的靶向代謝組學(xué)檢測服務(wù),歡迎有衣康酸、TCA循環(huán)等檢測需求的客戶咨詢。
[1]. Shin, J. H. et al. (1)H NMR- based metabolomic profiling in mice infected with Mycobacterium tuberculosis. J. Proteome Res. 10, 2238–2247 (2011).
[2]. Strelko, C. L. et al. Itaconic acid is a mammalian metabolite induced during macrophage activation. J. Am. Chem. Soc. 133, 16386–16389 (2011).
[3]. Sugimoto, M. et al. Non- targeted metabolite profiling in activated macrophage secretion. Metabolomics 8, 624–633 (2012).
[4]. Michelucci, A. et al. Immune- responsive gene 1 protein links metabolism to immunity by catalyzing itaconic acid production. Proc. Natl Acad. Sci. USA 110, 7820–7825 (2013).
[5]. Degrandi, D., Hoffmann, R., Beuter- Gunia, C. & Pfeffer, K. The proinflammatory cytokine- induced IRG1 protein associates with mitochondria. J. Interferon Cytokine Res. 29, 55–67 (2009).
[6]. Krawczyk, C. M. et al. Toll- like receptor- induced changes in glycolyti metabolism regulate dendritic cell activation. Blood 115, 4742–4749 (2010).
[7]. Jha, A. K. et al. Network integration of parallel metabolic and transcriptional data reveals metabolic modules that regulate macrophage polarization. Immunity 42 419–430 (2015).
[8]. Tannahill, G. M. et al. Succinate is an inflammatory signal that induces IL-1bet through HIF-1alpha. Nature 496, 238–242 (2013).
[9]. Cordes, T. et al. Immunoresponsive gene 1 and itaconate inhibit succinate dehydrogenase to modulate intracellular succinate levels. J. Biol. Chem. 291, 14274–14284 (2016).
[10]. Lampropoulou, V. et al. Itaconate links inhibition of succinate dehydrogenase with macrophage metabolic remodeling and regulation of inflammation. Cell Metab. 24, 158–166 (2016).
[11]. Ackermann, W. W. & Potter, V. R. Enzyme inhibition in relation to chemotherapy. Proc. Soc. Exp. Biol. Med. 72, 1–9 (1949).
[12]. Ahmed, S. M., Luo, L., Namani, A., Wang, X. J. & Tang, X. Nrf2 signaling pathway: pivotal roles in inflammation. Biochim. Biophys. Acta Mol. Basis Dis. 1863, 585–597 (2017).
[13]. Hayes, J. D. & Dinkova- Kostova, A. T. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism. Trends Biochem. Sci. 39, 199–218 (2014).
[14]. Bambouskova, M. et al. Electrophilic properties of itaconate and derivatives regulate the IkappaBzeta- ATF3 inflammatory axis. Nature 556, 501–504 (2018).
[15]. Mills, E. L. et al. Itaconate is an anti- inflammatory metabolite that activates Nrf2 via alkylation of KEAP1. Nature 556, 113–117 (2018).
[16]. Mills, E. L. et al. Succinate dehydrogenase supports metabolic repurposing of mitochondria to drive inflammatory macrophages. Cell 167, 457–470 (2016).
[17]. Levonen, A. L., Hill, B. G., Kansanen, E., Zhang, J. & Darley- Usmar, V. M. Redox regulation of antioxidants, autophagy, and the response to stress: implications for electrophile therapeutics. Free Radic. Biol. Med. 71, 196–20 (2014).
[18]. Gilchrist, M. et al. Systems biology approaches identify ATF3 as a negative regulator of Toll- like receptor 4. Nature 441, 173–178 (2006).
[19]. Quiros, P. M., Mottis, A. & Auwerx, J. Mitonuclear communication in homeostasis and stress. Nat. Rev. Mol. Cell Biol. 17, 213–226 (2016).
[20]. Olagnier, D. et al. Nrf2 negatively regulates STING indicating a link between antiviral sensing and metabolic reprogramming. Nat. Commun. 9, 3506 (2018).
[21]. Nelson, V. L. et al. PPARgamma is a nexus controlling alternative activation of macrophages via glutamine metabolism. Genes Dev. 32, 1035–1044 (2018).
[22]. Ganta, V. C. et al. A microRNA93-interferon regulatory factor-immunoresponsive gene-1-itaconic acid pathway modulates M2-like macrophage polarization to revascularize ischemic muscle. Circulation 135, 2403–2425 (2017).
[23]. Weiss, J. M. et al. Itaconic acid mediates crosstalk between macrophage metabolism and peritoneal tumors. J. Clin. Invest. 128, 3794–3805 (2018).
[24]. Dominguez- Andres, J. et al. The itaconate pathway is a central regulatory node linking innate immune tolerance and trained immunity. Cell Metab. 29, 211–220 (2018).