
手機掃碼訪問本站

微信咨詢
過氧化氫酶是一種廣泛存在于各類生物體中的酶,它是一類抗氧化劑,其作用是催化過氧化氫轉化為水和氧氣的反應。過氧化氫酶也是具有最高轉換數(與底物反應速率)的酶之一;在酶達飽和的狀態下,一個過氧化氫酶分子每秒能將四千萬個過氧化氫分子轉化為水和氧氣。
過氧化氫酶是一個同源四聚體,每一個亞基含有超過500個氨基酸殘基;并且每個亞基的活性位點都含有一個卟啉血紅素基團,用于催化過氧化氫的反應。過氧化氫酶的最適pH接近7,最適溫度則因物種而異。
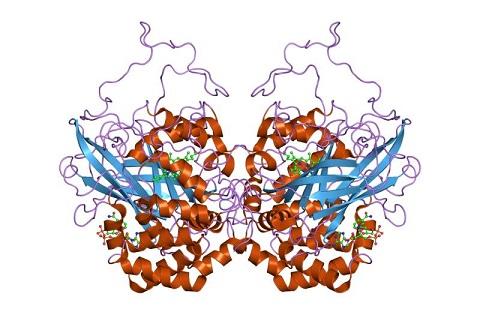
作為一種物質,過氧化氫酶是在1811年被過氧化氫(H2O2)的發現者泰納爾(Louis Jacques Thénard)首次發現。1900年,Oscar Loew將這種能夠降解過氧化氫的酶命名為“catalase”,即過氧化氫酶,并發現這種酶存在于許多植物和動物中。1937年,詹姆斯·B·薩姆納將來自牛肝中的過氧化氫酶結晶,并在次年獲得了該酶的分子量。1969年,牛的過氧化氫酶的氨基酸序列得以解出。而后,1981年,其三維結構得以解析。

過氧化氫分子
過氧化氫酶催化過氧化氫分解的反應可以表示如下:
2 H2O2→ 2 H2O + O2
雖然過氧化氫酶完整的催化機制還沒有完全被了解,但其催化過程被認為分為兩步:
H2O2+ Fe(III)-E → H2O + O=Fe(IV)-E(.+)
H2O2+ O=Fe(IV)-E(.+) → H2O + Fe(III)-E + O2
其中,“Fe()-E”表示結合在酶上的血紅素基團(E)的中心鐵原子(Fe)。Fe(IV)-E(.+)為Fe(V)-E的一種共振形式,即鐵原子并沒有完全氧化到+V價,而是從血紅素上接受了一些“支持電子”。因而,反應式中的血紅素也就表示為自由基陽離子(.+).
過氧化氫進入活性位點并與酶147位上的天冬酰胺殘基(Asn147)和74位上的組氨酸殘基(His74)相互作用,使得一個質子在氧原子間互相傳遞。自由的氧原子配位結合,生成水分子和Fe(IV)=O。Fe(IV)=O與第二個過氧化氫分子反應重新形成Fe(III)-E,并生成水分子和氧氣。活性中心鐵原子的反應活性可能由于357位上酪氨酸殘基(Tyr357)的苯酚基側鏈的存在(幫助Fe(III)氧化為Fe(IV))而得以提高。反應的效率可能是通過His74和Asn147與反應中間體作用而得以提高。該反應的速率通常可以通過米氏方程來確定。
過氧化氫酶也能夠氧化其他一些細胞毒性物質,如甲醛、甲酸、苯酚和乙醇。這些氧化過程需要利用過氧化氫通過以下反應來完成:
H2O2+ H2R → 2H2O + R
同樣,具體的反應機制還不清楚。
任何重金屬離子(如硫酸銅中的銅離子)可以作為過氧化氫酶的非競爭性抑制劑。另外,劇毒性的氰化物是過氧化氫酶的競爭性抑制劑,可以緊密地結合到酶中的血紅素上,阻止酶的催化反應。
處于過氧化狀態的過氧化氫酶中間體的三維結構已經獲得解析,可以在蛋白質數據庫中檢索到。
過氧化氫是一種代謝過程中產生的廢物,它能夠對機體造成損害。為了避免這種損害,過氧化氫必須被快速地轉化為其他無害或毒性較小的物質。而過氧化氫酶就是常常被細胞用來催化過氧化氫分解的工具。
但過氧化氫酶真正的生物學重要性并不是如此簡單:研究者發現基因工程改造后的過氧化氫酶缺失的小鼠依然為正常表現型,這就表明過氧化氫酶只是在一些特定條件下才對動物是必不可少的。
一些人群體內的過氧化氫酶水平非常低,但也不顯示出明顯的病理反應。這很有可能是因為正常哺乳動物細胞內主要的過氧化氫清除劑是過氧化物還原酶(peroxiredoxin),而不是過氧化氫酶。
過氧化氫酶通常定位于一種被稱為過氧化物酶體的細胞器中。植物細胞中的過氧化物酶體參與了光呼吸(利用氧氣并生成二氧化碳)和共生性氮固定(將氮氣(N2)解離為活性氮原子)。
但細胞被病原體感染時,過氧化氫可以被用作一種有效的抗微生物試劑。部分病原體,如結核桿菌、嗜肺軍團菌和空腸彎曲菌,能夠生產過氧化氫酶以降解過氧化氫,使得它們能在宿主體內存活。