
手機掃碼訪問本站

微信咨詢
克里唑替尼(亦翻譯為:克唑替尼)是FDA批準的首個非小細胞肺癌精準藥物,也是腫瘤藥物研發史上開發最快的四大傳奇藥物之一。2006年,克里唑替尼被發現對攜帶EML4-ALK融合基因表達的腫瘤細胞具有抑制作用,并開始I期臨床試驗,2011年克里唑替尼通過快速通道被FDA批準上市,并引發轟動,主導發明人華裔女科學家崔景榮博士也因此榮獲第38屆美國國家發明者年度獎,每年全美各行業中只有一個專利可獲此殊榮。
克里唑替尼的研發歷程既有偶然的成分也有必然的成分,偶然的是克里唑替尼本是基于c-Met激酶結構進行設計的,卻對ALK激酶具有強效的抑制活性,而必然的是由苗頭化合物向先導化合物過度時是依據傳統的藥物化學和構效關系為策略進行的,同時利用復合物晶體結構對結構進行“量體裁衣”式的優化,后期則用親親脂性效率對成藥性進行全程“監視”。“變幻莫測”卻“有的放矢”就是科學的魅力所在。
輝瑞研發的舒尼替尼于2006年上市,該藥對多種酪氨酸激酶均有較強的抑制活性,故可用于治療對伊馬替尼耐藥的胃腸道間質瘤患者。循此研發路徑,輝瑞繼續著手研發與其他激酶有關的腫瘤藥物。間充質上皮轉化因子激酶 (c-Met) 也是受體酪氨酸激酶,其信號通路對發育、器官形成和機體穩態起著重要作用,因此c-Met被認為是腫瘤藥物治療的重要靶標。
考慮到羥基吲哚的N-H和C=O結構可與激酶通過氫鍵結合,故輝瑞對具有羥基吲哚結構的化合物進行篩選發現,衍生物1對c-Met激酶具有較強的抑制活性(IC50=10 nmol·L-1),且在1μmol·L-1濃度下可因抑制c-Met而完全阻止A549細胞的生長,故認為衍生物1具有較好的開發潛能。
為了提高該衍生物對c-Met激酶的選擇性,研究人員分別在母核的4位或5位分別引入取代苯基和芐基磺酰基側鏈,設計并合成了一系列衍生物。

對合成近千個化合物進行活性測定發現,衍生物4對c-Met激酶具有較高的選擇性,強于對其他激酶抑制活性的50倍以上,且對c-Met激酶的抑制活性亦較高(IC50=9 nmol·L-1);體內實驗表明,化合物4能抑制移植性腫瘤細胞的c-Met磷酸化,其活性參數測定結果為:配體效率LE=0.25、親脂性效率LipE=4.85、分布系數logD=3.20,故化合物4可作為候選化合物進入開發階段。
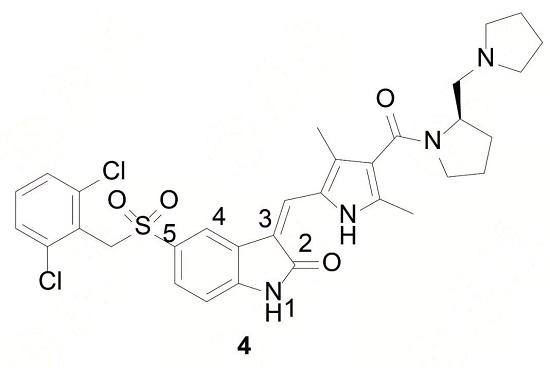
通過對化合物4與c-Met激酶的復合物晶體結構分析發現:(1) 結合域的 A-環套采取了獨特的自身抑制狀態的構象,即在激酶的活化環套殘基1222~1227形成轉折,占據了αC螺旋的催化位置,使得1228~1245環套殘基移位,干擾了ATP 與底物的結合;(2) 吲哚酮的N-H和C=O基團與激酶的殘基分別形成氫鍵;(3) 吲哚酮的C=O與吡咯環的N-H形成分子內氫鍵,因而吲哚酮與吡咯環形成較大的共軛平面,處于ATP的腺嘌呤環結合的平面裂隙處;(4) 連接羥基吲哚與二氯苯基的連接基磺酰亞甲基形成U-形轉折,使二氯代芐基與具有獨特構象的A-環套上Tyr1230的苯酚環發生π-π堆積作用;(5) 磺酰基的氧原子與 Asp1222的N-H形成氫鍵,穩定了分子取向;(6) 與吡咯環相連的酰胺及延伸的片段進入了水相,未與蛋白結合。
從結合信息可知,二氯苯基為了可與Tyr-1230發生π-π堆積作用,磺酰亞甲基自行進行U-形轉折,可能是由于二氯苯基、吲哚酮及吡咯環形成的共軛平面過大,故需縮小其基本骨架。基于骨架躍遷原理,首先將吲哚酮與吡咯的分子內氫鍵“固化”成共價鍵,為氮雜吖啶5;隨后切斷C-N鍵形成2-氨基-3-苯基吡啶化合物6;最后進一步簡化連接基團,得到衍生物7。

雖然衍生物7對c-Met激酶的抑制活性較弱Ki=3.83μmol·L-1,但是由于分子量比較低,其配體效率優于5(LE=0.29),但親脂性效率有所降低(LipE=0.35)。故可在衍生物苯環的羥基處引入極性側鏈,引入嗎啉亞乙基得到衍生物8,活性略有提高(Ki=2.45 μmol·L-1),但是降低了配體率,隨后模仿衍生物4的片段,得到9,抑制活性和親脂性效率均有所提高,Ki=0.46μmol·L-1,LE=0.24,LipE=3.70。
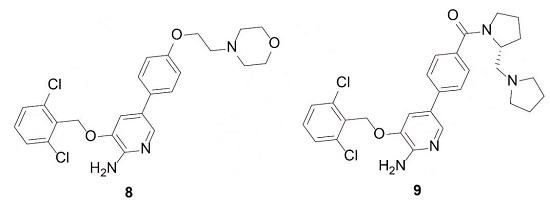
為了考察環上取代基對活性Ki和親脂性效率LipE的影響,在苯環上引入一個或多個、相同或不同的鹵素,連接鏈或用甲基取代、或不取代,合成了一系列通式10的衍生物,活性測定發現,衍生物11的活性最高,對c-Met酶的活性參數為:Ki=0.012μmol·L-1、LipE=4.82;對c-Met細胞的活性參數為:IC50=0.020μmol·L-1、 LipE=4.60。
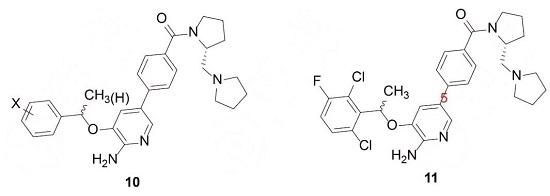
根據復合物的晶體結構,5-苯基結合于Tyr1159、Ile1084和Gly1163構成的疏水性狹窄裂隙,這需要確保在氨基吡啶的5位連接的芳環具有平面性,芳基上連接的基團延伸到溶劑相中。此外,11中的酰胺片段已離開疏水裂隙,進入水相,提示延伸的親水性片段可不必經酰胺鍵連接。
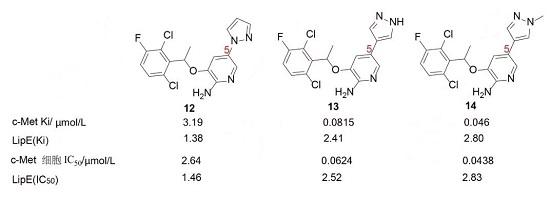
用五元含氮芳環替換5-苯環可增加水溶性,例如含5-吡唑或咪唑化合物的 cLogD比相應的苯化合物低2個單位,并且較小扭角,增加了共面性,有利于結合。氨基吡啶與吡唑環的連接方式對活性影響很大,例如化合物12和13的活性以及 LipE 值相差很大。結構生物學表明,12的吡唑環氮原子所處的位置使得c-Met的殘基Met1160和Ile1084取向與吡唑環鄰近,不利于氨基吡啶的氫鍵結合,而且該吡唑環處于酶蛋白的疏水性界面,為了發生疏水-疏水相互作用,N原子的孤電子對的去水合作用是不利的焓變;而13的N原子都進入了水相,沒有上述的不利效應,因而活性高12,酶或細胞活性提高了30~40倍。化合物13的N-甲基化后產14的活性更強,提示由這個N原子可引出含有極性基團的碳鏈,以提高活性水溶性。
鑒于化合物9結構中含有延伸到水相的堿性基團能夠提高活性和親脂性效率,因而也在吡咯環系上引入盡可能小的堿性片段,例如鏈烷基,胺、氮雜環丁烷、四氫吡咯、哌啶等,以增加活性和改善藥學和藥代性質。在選擇高活性和高親脂性效率的化合物同時,還評價對人肝微粒體的穩定性,從有代表性的化合物中優選出15和16,尤其是因16的高活性和較好的代謝穩定性,確定為候選藥物。
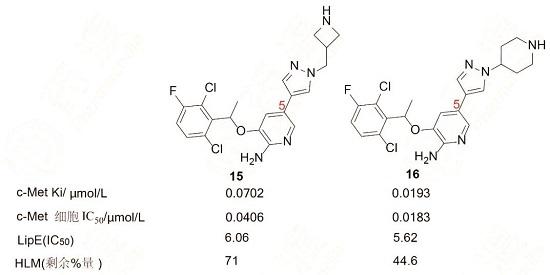
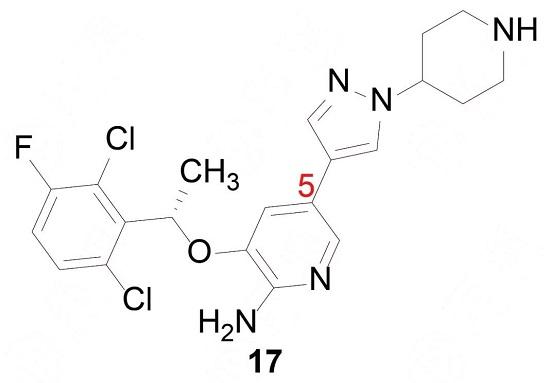
前述優化過程制備的吡唑系列化合物含有手性碳原子,都是用混旋的樣品測定活性的。將優選出的化合物16拆分成光學活性物質,活性測定表明,R-構型的分17活性強于RS和S構型,對酶和細胞抑制活性分別為Ki = 0.002μmol·L-1和IC50=0.008μmol·L-1,命名為克里唑替尼(crizotinib)。
克里唑替尼從2007年立項到2011年FDA批準上市,僅用了4年時間,它的出現是個體化治療的又一重大突破,其在臨床上的地位超越了常規化療,是當前ALK 陽性的晚期非小細胞肺癌患者標準藥物。
1 Cui JR, et al. 4-Aryl substituted indolinones. WO02/055517
2 Cui JR, et al. 5-Aralkylsulfonyl-3-(pyrrol-2-ylmethylidene)-2-indolinones as kinaseinhibitors. WO 02/096361
3 Cui JR, Tran DM, Shen H, et al. Structurebased drug design of crizotinib (PF-02341066), a potent and selective dualinhibitor of mesenchymal-epithelial transition factor (c-MET) kinase andanaplastic lymphoma kinase (ALK). J Med Chem, 2011, 54: 6342-6363
4 Roberts PJ. Clinical use of crizotinib for thetreatment of non-small cell lung cancer. Biologics, 2013, 7: 91–101.