
手機掃碼訪問本站

微信咨詢
替普瑞酮是臨床上常用的抗胃潰瘍藥物,近年來發現其同時也是一種無明顯不良反應的HSP誘導劑,可誘導各種組織器官中HSP的表達并發揮多種保護作用。
替普瑞酮,又名戊四烯酮,是樹汁中的萜類物質,黃色油狀液體,可溶于乙醇等有機溶劑,油水分配系數約為9,難溶于水,是日本衛材制藥株式會社于1984年上市的一種新型抗消化性胃潰瘍藥。近年來隨著研究的深入,發現替普瑞酮可作為一種無明顯不良反應的HSP誘導劑,其結構中的類維生素A骨架能夠誘導各種組織器官,如胃黏膜、小腸、大腦、心臟、肝臟、腎臟、肺、視網膜中HSP的表達[8,9,10,11],許多研究發現在缺血、缺氧、氧化刺激等應激情況下,替普瑞酮通過增加體內HSP的表達對各種組織器官起保護作用[8,11,12,13]。因此,替普瑞酮在組織器官保護方面有良好的應用前景。2001年Ooie等[13]首次發現替普瑞酮能通過誘導心臟HSP72表達發揮抗心肌缺血再灌注損傷作用,這一發現引起了廣泛關注,并在此基礎上對替普瑞酮的心肌保護作用及其機制進行了更深入的研究。
1.誘導HSP70/HSP72表達:
在大鼠心臟缺血再灌注模型中,口服單劑量(200 mk/kg)的替普瑞酮能夠通過誘導心臟HSP72表達發揮抗心肌缺血再灌注損傷的作用[13,14,15,16]。在復灌注期間,替普瑞酮預處理可明顯減少缺血20或40 min模型中肌酸激酶的釋放,并且左心室功能明顯恢復;口服替普瑞酮24 h后HSP72表達達到高峰值,雖然HSP72的表達呈劑量依賴性,但口服單劑量達200 mg/kg時,誘導HSP72表達的藥效達到最大[13]。因此,許多基礎研究以200 mg/kg作為動物模型的給藥劑量。目前尚無研究證實替普瑞酮同樣可誘導人體心臟內HSP72表達,但是有研究證實口服替普瑞酮(600 mg)能明顯增加人體外周血單核細胞HSP72及HSP90表達[17]。另外,胰島素抵抗能減弱替普瑞酮對HSP72的誘導及其抗心肌缺血再灌注損傷作用[16](圖1)。
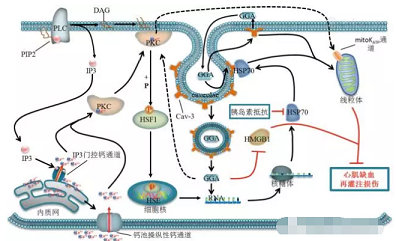
圖1 替普瑞酮在心肌缺血再灌注損傷中的保護作用及其機制示意圖(替普瑞酮可能參與了PKC信號轉導系統的激活,使細胞內游離Ca2+濃度升高,從而通過激活PKC調節HSP70的表達,HSP70在心肌線粒體保護作用中發揮重要作用,并且替普瑞酮能誘導Cav-3表達上調,Cav-3介導對替普瑞酮的攝取及HSP70的胞膜窖定位,也是HSP70激活及隨后線粒體呼吸之間的重要導線,因此線粒體是替普瑞酮心肌保護作用的靶點,同時PKC可能參與激活mitoKATP通道從而保護線粒體呼吸功能)
在后續研究中,許多研究者對替普瑞酮抗心肌缺血再灌注損傷作用機制進行了深入探索。Yamanaka等[14]研究發現蛋白激酶C(protein kinase C,PKC)在替普瑞酮誘導HSP72表達和心肌保護作用中具有至關重要的作用。替普瑞酮能夠誘導PKC轉位并激活,活化的PKC進一步使熱休克因子1(heat shock factor 1,HSF1)磷酸化,隨后磷酸化的HSF1從細胞質轉位至細胞核內并且結合于HSP72基因的熱休克元件(heat shock elements,HSE),進而啟動HSP72基因表達并發揮心肌保護作用(圖1)。但替普瑞酮誘導的PKC激活的信號通路仍有待進一步研究,其可能參與了PKC信號轉導系統的激活,細胞內游離Ca2+濃度升高在此過程發揮重要作用(圖1)。研究還發現替普瑞酮能通過抑制高遷移率族蛋白1(high mobility group box 1 protein,HMGB1)表達減輕缺血再灌注損傷[18](圖1)。
此外,線粒體是替普瑞酮抗缺血再灌注損傷的作用靶點[15]。替普瑞酮能通過誘導HSP72表達,減輕心肌缺血再灌注損傷引起的線粒體超微結構的損害,改善心肌細胞線粒體呼吸,從而發揮抗心肌缺血再灌注損傷的作用(圖1)。并且線粒體ATP敏感性鉀通道(mitochondrial ATP-sensitive potassium channel,mitoKATP channel)的開放可能參與了替普瑞酮線粒體保護作用。Kitahata等[19]同樣發現替普瑞酮的心肌保護作用可能與mitoKATP通道相關。而mitoKATP通道的激活受到PKC調控[20],因此替普瑞酮可能通過誘導PKC轉位并激活mitoKATP通道進而保護線粒體功能,從而發揮抗心肌缺血再灌注損傷作用。
2.誘導窖蛋白3表達:
替普瑞酮的抗缺血再灌注損傷作用還與胞膜窖和窖蛋白3有關。替普瑞酮能通過誘導窖蛋白3的表達與胞膜窖的形成,從時間與空間上優化經線粒體保護性信號傳導通路而發揮心肌保護作用[21]。窖蛋白3參與胞膜窖對替普瑞酮的攝取和介導HSP70的胞膜窖定位與激活,并且直接影響線粒體功能(圖1)。此外,另一項研究發現聯合應用替普瑞酮和異氟烷預處理能發揮協同抗心肌缺血再灌注損傷作用,并且這一保護作用同樣受到窖蛋白3的介導[21]。Kitahata等[19]觀察到七氟烷也能夠強化替普瑞酮的此種心肌保護作用,并且該保護作用與誘導HSP70表達相關。但是這些研究均無法證實誘導HSP70表達和心肌保護作用之間存在直接聯系。
3.保護內皮功能:
口服替普瑞酮能減輕缺血再灌注損傷導致的心臟血管內皮功能障礙而發揮心肌保護作用,PI3激酶及Rho激酶可能參與了該保護作用[22]。此外有研究發現替普瑞酮的內皮保護作用與誘導HSP90表達相關,其可激活HSP90-AMPK-eNOS-NO信號通路而改善內皮功能障礙[17]。可以看出替普瑞酮的抗缺血再灌注損傷作用與其誘HSP70/HSP72表達密切相關。在乳鼠心肌細胞建立缺氧復氧模型中,HSP72特異的小干擾RNA消除了替普瑞酮對HSP72的誘導表達作用并且替普瑞酮此種保護作用消失,因此體外實驗證實替普瑞酮的心肌保護作用與HSP72存在直接聯系[15]。但在許多體內實驗中發現除了熱休克蛋白,替普瑞酮還能誘導其他保護性蛋白的合成,如NOS、硫氧還蛋白等。所以HSP72尚不能作為替普瑞酮抗缺血再灌注損傷作用的唯一解釋。有研究觀察到在大鼠心肌缺血再灌注損傷模型中,替普瑞酮對HSP27、HSP60、NOS(包括iNOS、nNOS及eNOS)、硫氧還蛋白等保護性蛋白并沒有誘導表達作用[13],其他保護性蛋白,如HSPB5、HSPB8、HSP90等的作用仍有待研究。雖然目前的體內實驗只能提供一些排除性證據,但是仍然可以確定HSP72在替普瑞酮抗心肌缺血再灌注損傷作用中具有核心地位。
1.抑制房顫的發生:
各種器質性心臟病的早期與加劇過程常伴隨電重構,主要是心肌細胞動作電位時程(action potential duration,APD)發生適應性延長,使Ca2+內流代償性增加,進而使心肌收縮力代償性增強。但電重構在發揮代償作用的同時也將引起細胞內鈣超載和異常觸發活動事件,成為各種心律失常發生的基質。許多研究證實誘導HSP表達能夠阻止房顫的致心律失常基質產生[23]。作為HSP誘導劑,替普瑞酮能夠改善各種原因,如心肌缺血、心力衰竭(心衰)等,引起的電重構改變,從而抑制房顫的發生。
替普瑞酮可減輕缺血引起的心房傳導異常從而抑制缺血相關房顫的發生[24],這種保護作用表現為抑制缺血部位有效不應期(effective refractory period,ERP)延長、傳導遲滯及傳導模式的改變。該研究觀察到替普瑞酮對犬心房缺血模型中HSP72(并非HSP27)的表達有明顯誘導作用,其可能通過誘導HSP72表達在抑制缺血誘導房顫基質產生的作用中發揮重要作用。在兔的心衰模型中,替普瑞酮同樣可通過誘導HSP表達抑制ERP與APD延長,可逆轉心衰所致的電重構,減少觸發活動及APD離散度從而降低房顫誘發率[25]。這些保護作用可能與其誘導各種鈉通道及鉀通道蛋白表達和維持鈣穩態相關。其能夠誘導Cav1.2、Nav1.5、Kir2.1、Kv1.4、Kv7.1和Kv11.1等離子通道蛋白與心肌細胞肌漿網鈣ATP酶(sarcoplasmic reticulum Ca2+-ATPase,SERCA2a)mRNA的表達,從而縮短ERP,減弱心肌細胞對APD交替的易感性及抑制觸發活動。
2.抑制房顫的進展:
心房重構所引起的電生理變化增加房顫啟動和持續的可能性,其生理電重構主要表現為ERP和APD縮短。多項研究表明替普瑞酮可通過誘導HSP表達抑制房顫進展。在細胞房顫重構模型中,Brundel等[26]發現替普瑞酮可抑制節律加速細胞內L型鈣電流的減弱及APD縮短,使鈣瞬變及細胞收縮減弱,此種保護作用需要HSP27的表達及磷酸化。他們還通過快速心房起搏建立了實驗犬房顫重構模型,發現替普瑞酮抑制了心動過速導致的ERP縮短及房顫的啟動。Brundel等[27]還發現替普瑞酮幾乎能夠完全抑制房顫細胞模型中節律加速所致的肌纖維溶解,從而抑制房顫的進展。
以上2項研究均認為替普瑞酮抑制房顫進展的作用與HSP27而非HSP70相關,他們都通過基因轉染發現HSP27過表達可復制替普瑞酮在實驗中所觀察到的保護作用。其中一項研究還發現通過敲除HSP27基因可阻斷替普瑞酮介導的保護作用[26]。另一項研究還將結果擴展到了房顫患者,在陣發性及持續性房顫中,HSP27水平與房顫持續時間及肌溶解數量呈負相關[27]。體內實驗中,Zhang等[28]建立了可行基因操作的果蠅房顫模型,發現替普瑞酮和DmHSP23過表達均可改善節律加速心肌細胞的重構及果蠅心臟收縮功能障礙,而該研究認為DmHSP23與人類HSP27在功能上屬直系同源。因此,替普瑞酮可通過誘導HSP27表達抑制心房重構和房顫的進展。
盡管諸多實驗均證實替普瑞酮對房顫有治療作用,但是由于替普瑞酮的油水分配系數很高,大約為9,因此需要高劑量才能起效[24,26]。為了克服這一缺點,荷蘭的HALT&REVERSE項目合成了替普瑞酮的各種衍生物,擁有更佳的藥理化學特性及促HSP表達作用[29,30]。并且替普瑞酮及其衍生物的HSP誘導作用呈刺激依賴性,在正常情況下其HSP誘導作用較弱,預示著其不良反應較少[30]。其中一些衍生物在體外實驗中被證實存在保護作用,并且其中一種衍生物將被應用于房顫動物模型。此外,已有相關研究在心臟手術后的患者中測試替普瑞酮能否誘導心房HSP表達及抑制術后房顫的發生[29]。
動脈粥樣硬化是一種慢性炎癥性疾病,是心血管疾病的主要病理基礎。內皮細胞黏附分子(endothelial cell adhesion molecules,ECAM)介導的組織內異常白細胞聚集參與了動脈粥樣硬化慢性炎癥反應過程。替普瑞酮可增強高溫(42 ℃)刺激對人體動脈內皮細胞HSP70的誘導表達作用,進一步阻止腫瘤壞死因子(TNF)α誘導的核因子(NF)-κB激活,進而減弱ECAM的表達,抑制內皮異常白細胞聚集[31]。此外,替普瑞酮還可通過抑制NF-κB激活減弱血管平滑肌細胞iNOS的表達,阻止炎癥狀態下NO的過量合成從而減輕細胞損傷及炎癥反應,表明其可調節動脈粥樣硬化等心血管疾病的病理生理過程[32]。胰島素抵抗是動脈粥樣硬化性心血管疾病發生、發展的危險因素之一。替普瑞酮可通過誘導HSP70增強衰老小鼠胰島素敏感性從而延長壽命[33],研究還發現替普瑞酮在改善高脂飲食小鼠胰島素抵抗的同時還能改善腹形肥胖,其機制與誘導HSP72表達及抑制氨基末端激酶(jun-NH2-terminal kinase, JNK)激活有關[34]。
心肌細胞凋亡是物理化學等有害刺激,如濕熱刺激、化療藥物引起心肌損傷的重要機制之一,在各種心血管疾病的病理過程中發揮重要作用。在小鼠的濕熱刺激模型中,替普瑞酮能通過增加HSP70表達抑制濕熱刺激誘導的心肌細胞凋亡,其機制主要是通過增加Bcl-2表達及抑制線粒體內細胞色素C釋放從而抑制線粒體介導的凋亡[35]。最近的一項研究發現替普瑞酮還能通過誘導HSP70表達抑制應激誘導的心肌細胞凋亡,并且HSP70能通過競爭性與FAF1結合抑制Fas信號通路激活進而抑制凋亡[36]。此外,在小鼠的結蛋白相關的心肌病(desmin-related cardiomyopathy,DRM)模型中,替普瑞酮通過誘導HSPB8表達從而抑制線粒體細胞色素C釋放、caspase-3激活和心肌細胞凋亡[37]。替普瑞酮在與化療藥物多柔比星聯用時還能通過阻斷RHO/ROCK1途徑抑制多柔比星誘導的心肌細胞死亡、氧化應激損傷及心臟功能障礙而發揮心肌保護作用,同時還能增強多柔比星的抗腫瘤作用[38]。另有研究發現替普瑞酮具有明顯的促凋亡作用,在很低濃度(0.1 μmol/L)時就能誘導白血病細胞HL-60凋亡[39]。
HSPB5基因Arg120Gly(R120G)位點錯義突變會引起結蛋白相關的心肌病。研究發現替普瑞酮不僅能誘導R120G轉基因小鼠體內HSPB8及HSPB1表達,還能抑制心臟擴大及間質纖維化,從而恢復心臟功能和促進存活;HSPB8過表達同樣能抑制R120G小鼠心肌病的進展[37]。此外,Marunouchi等[40]發現替普瑞酮通過誘導HSPB1及HSPB8表達減輕心肌梗死后線粒體能量合成障礙而改善心臟收縮功能。因此,替普瑞酮也許能通過誘導sHSP表達成為治療DRM及心肌梗死后心衰的新方法。
綜上所述,作為一種無明顯不良反應的HSP誘導劑,替普瑞酮可發揮多種心肌保護作用。替普瑞酮可改善心肌缺血再灌注損傷,抑制各種原因引起的房顫的發生與進展,改善動脈粥樣硬化,減輕濕熱刺激及化療藥物所致的心肌損傷,對DRM、心衰及胰島素抵抗也有一定的治療作用。此外,替普瑞酮還可以改善內皮功能,抑制心肌細胞凋亡、肌溶解及保護線粒體功能。值得注意的是,阿司匹林在心血管疾病患者中廣泛應用,以往研究發現替普瑞酮對阿司匹林所致的胃黏膜損傷亦有一定保護作用[41],與質子泵抑制劑相比替普瑞酮是否可使心血管疾病患者獲益更多?雖然其胃黏膜保護作用在臨床上得到廣泛認可,但其心肌保護作用還僅局限于動物實驗,具體作用機制還不甚清楚。替普瑞酮也許可以為臨床各種心血管疾病提供新的治療方式,其各種衍生物具有更佳的藥物化學特性及更強的HSP誘導作用,但是替普瑞酮的心肌保護作用還有待進一步證實。