
手機掃碼訪問本站

微信咨詢
蛋白激酶幾乎調節細胞生命的所有方面,其表達的改變或基因的突變會導致癌癥和其他疾病。比如,經典的MAP激酶級聯突變會導致癌癥。從伊馬替尼2001年上市開始,激酶抑制劑藥物已經走過了20個年頭。蛋白激酶能否作為藥物靶點此前曾受到許多制藥公司的懷疑。直到1998年伊馬替尼進入臨床試驗改變了人們對蛋白激酶作為藥物靶點的看法。從那時起,數百種蛋白激酶抑制劑被開發出來,并在人體上進行了測試,由此開啟了靶向藥物開發的時代。
最近,一篇發表在《Nature Reviews Drug Discovery》雜志上的綜述總結了這20年激酶藥物發展及治療的現狀,梳理了抗藥性的原因和可能的解決方法。還預測了后20年這類藥物發展的可能性。
2001年,第一個激酶抑制劑伊馬替尼(格列衛)獲得了FDA的批準。伊馬替尼是首個通過針對特定蛋白激酶開發的藥物。它是由瑞士諾華公司研制出的、也是人類第一個用于抗癌的分子靶向藥。
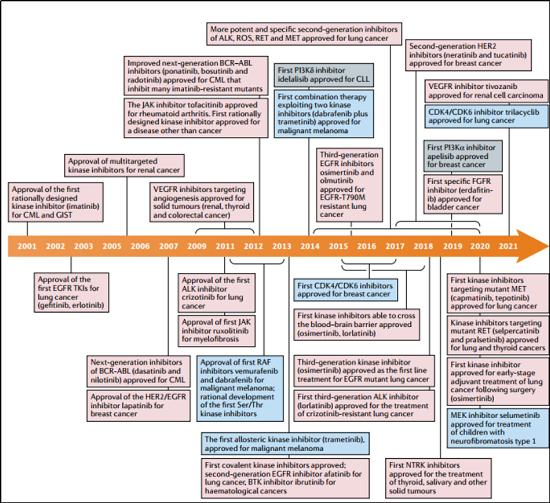
哈佛醫學院醫學Pasi A. J?nne教授幫我們總結了自2001年伊馬替尼獲批以來,批準的76個激酶新藥。
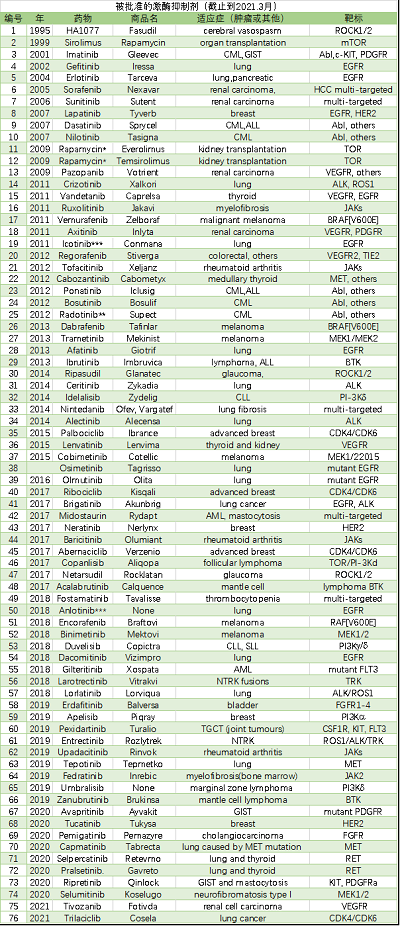
從目前藥物使用來看,除了開發下一代抑制劑外,也開始通過靶向血管增生、PI3K通路來進行治療探索,還通過跟上代藥物或者不同靶點抑制劑、免疫療法進行聯用開發。目前,激酶抑制劑在一線療法及輔助治療范圍取得了巨大成功。這些化合物對我們現在治療癌癥和非癌癥疾病的方式已經產生了重大影響。比如,多個臨床試驗都表明,針對性的對基因型使用基因型導向治療(針對EGFR突變和alk重排的NSCLC)可提高應答率和無生存期(PFS),并減少不良副作用。再比如,血腦屏障是治療晚期腫瘤轉移的一大障礙,一些新一代激酶抑制劑包括奧希替尼、阿樂替尼、布加替尼、氯拉替尼、司培卡替尼和卡馬替尼已證明NSCLC患者的臨床中樞神經系統活性。
盡管批準的激酶抑制劑無疑給許多癌癥患者帶來了巨大的好處,但這些藥物并不能治愈。大多數藥物只能延緩腫瘤的進展,因為晚期腫瘤找到逃避途徑來繞過靶標抑制,導致耐藥性。對激酶抑制劑的耐藥性可大致分為原發性耐藥性和獲得性耐藥性。即使腫瘤存在與特定激酶抑制劑致敏相關的致癌驅動突變,也不是所有的腫瘤細胞都有反應,而其他細胞只表現出短暫的獲益時間。這可能是由于腫瘤的外部因素,如藥物對靶激酶產生的抑制不足或與激酶的關聯時間不夠長。
原發性的耐藥。盡管在EGFR突變的NSCLC中存在致瘤依賴,但由于存在新生的MET擴增或EGFRT790M突變,一部分患者在使用早期EGFR抑制劑治療時并沒有實現腫瘤收縮,這介導了對這些藥物的主要耐藥性。類似的觀察也出現在其他治療環境中,包括使用激酶抑制劑的其他類型的癌癥。增加對來自腫瘤組織和血漿的NGS數據的獲取將繼續是關鍵,并導致對腫瘤分子異質性的更深層次的理解。反過來,這將指導解決原發耐藥性所需的策略,如聯合療法。
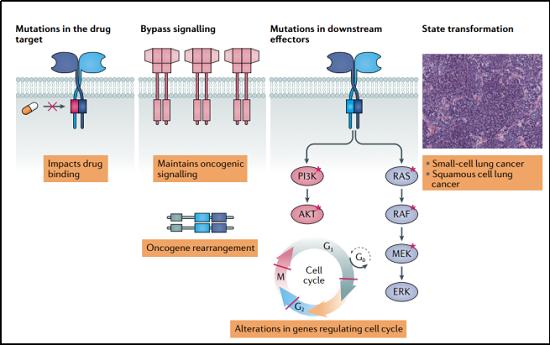
獲得性耐藥性。相對于原發性耐藥,獲得性耐藥才是更應該引起研究者注意的。獲得性耐藥機制可由靶點蛋白再次突變、獲得“旁路”信號通路或通過組織學轉化引起。如果是腫瘤轉移定植成新的腫瘤,則是由腫瘤微環境生物學的改變引起,或者是轉移性腫瘤細胞通過尋找抑制劑無法進入的避難所(如中樞神經系統)而逃避抑制劑造成的。
腫瘤細胞對藥物產生耐藥性的一個普遍機制是通過增加藥物轉運體的表達和活性,例如多藥耐藥蛋白或腦癌耐藥蛋白,它們積極地將藥物從細胞中運出。這種機制也可能阻止激酶抑制藥物在中樞神經系統內達到臨床有效濃度,因為中樞神經系統中這些藥物轉運體有高水平表達。
值得一提的是獲得性耐藥性的第二個主要機制:癌細胞繞過靶向激酶。這可能發生在另一個激酶(或多個激酶)的過表達或擴增,然后模仿藥物激酶的作用。例如,在非小細胞肺癌中,腫瘤細胞通常通過擴增編碼MET的基因來對EGFR抑制劑產生反應。這些RTK會開啟相同的下游信號通路。如果不受藥物抑制,這些下游信號通路通常也會被突變的EGFR激活(即RAF-MEK-ERK和PI3K-PDK1-AKT通路)。在乳腺癌中,對靶向HER2過表達的藥物的耐藥性同樣與轉向替代RTKs(包括MET、HER3和IGF1R)有關。比如,在雌激素受體陽性乳腺癌中,對CDK4/CDK6抑制劑ribociclib(瑞博希尼)和palbociclib(帕博希尼)的耐藥性是通過獲得性上調CDK6及其激活因子cyclin D1,導致這些藥物對CDK6的抑制效果較差。CDK2/cyclin E活性的上調是palbocicli耐藥的另一個原因,它可以通過聯合使用CDK2和CDK4/CDK6抑制劑來抑制。
在過去的20年里,在了解獲得性耐藥性的機制和制定策略以延長患者的治療受益時間方面取得了相當大的進展。
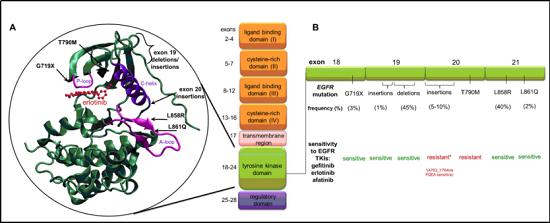
一個主要的方法是開發新一代藥物,不僅具有增強選擇性和減少副作用,而且能夠處理由“看門人”和其他位點突變引起的靶標耐藥。這種方法導致了在多種疾病環境中針對同一靶點的不同藥物的連續批準。一個重要的例子,是一種EGFR抑制劑,用于治療由EGFR激酶結構域“看門人”位點T790M突變引起的吉非替尼(gefitinib)和埃洛替尼(erlotinib)的靶向耐藥性。
最初,第二代抑制劑afatinib(阿法替尼)和dacomitinib(達克替尼)的設計目的是增強效力,并試圖克服第一代抑制劑的耐藥限制。盡管這些化合物已被批準用于臨床,但它們的一個關鍵缺點是對野生型EGFR活性增加,這加劇了常見的副作用,如皮疹和腹瀉。由于這些副作用限制了大多數患者的劑量,因此不可能在臨床環境中使用這些化合物的濃度來有效處理T790M突變。這一挑戰促使幾家公司采取創新策略,開發專門針對EGFR-T790M突變體的第三代抑制劑,同時保持對初始激活突變的活性,并對野生型EGFR保持足夠的選擇性,以解決afatinib(阿法替尼)和dacomitinib(達克替尼)的局限性。于是,第一個第三代EGFR抑制劑osimertinib(奧希替尼)被開發和批準。
與化療相比,奧希替尼不僅改善了EGFR-T790M人群的PFS,而且與第一代抑制劑吉非替尼和厄洛替尼相比,在EGFR突變的一線治療中也改善了PFS。因此,奧希替尼已成為治療的標準,目前被用作EGFR突變NSCLC的一線治療,使所有患者都能受益于生存期的改善,無論他們是否攜帶EGFRT790M突變。然而,盡管奧希替尼有效,癌細胞仍然發現獲得性耐藥性的其他途徑來逃脫奧希替尼的抑制,包括EGFRC797S突變,這阻止了奧希替尼與EGFR共價結合,或通過MET的擴增繞過EGFR產生耐藥機制。因此,需要針對新的突變進行藥物設計和篩選出下一代的抑制劑。
另外,也可以通過開發新的突變或者繞過途徑通路中的靶點來開發新的藥物。如果能很清楚的知道耐藥性質,利用已有的藥物進行聯用也是一個比較好的選擇。
激酶藥物現在的適應癥已經擴展到平滑肌松弛和免疫抑制、炎癥和自身免疫性疾病、阿爾茨海默病、帕金森病以及其他由激活蛋白激酶突變引起的疾病。盡管人類基因組編碼的500種蛋白激酶中只有50種被用于癌癥的治療,但Pasi A. J?nne教授仍然認為在未來20年,腫瘤將繼續主導激酶藥物的發現領域。而且他和團隊還預測,未來抗癌藥物開發中靶向的新激酶的數量只會小幅增加。原因是近年來,驅動特定癌癥的激酶的新突變還沒有被發現。
腫瘤基質微環境和免疫生物學在癌細胞保護中的作用將是一個重點研究領域。主要關注于確定和開發可以靶向類似于TAM (TYRO3, TYRO3和MER)和 CSF1R的激酶小分子抑制劑。這些激酶在免疫信號傳遞中起關鍵作用,它們可能補充或取代生物藥物的免疫腫瘤學方法。
蛋白質激酶抑制劑抗體相關開發也是一個熱門領域。靶向RTK或其激活配體的抗體已獲批準多年,例如用于HER2陽性乳腺癌患者的抗HER2抗體曲妥珠單抗(herceptin)和用于實體腫瘤治療的抗VEGF抗體貝伐單抗(Avastin)。那么下一代抗體方法將導致更多藥物獲得批準,其中將包括雙特異性抗體,可以阻斷不止一個激酶。Amivantamab (JNJ-61186372)是一種由強生開發的MET/EGFR雙抗,在臨床開發中已經顯示出令人鼓舞的數據。國內也有很多公司也開發了相似的產品。去年年底,強生已經向FDA以及EMA提交了上市申請,并于今年5月21日獲批上市。抗體藥物偶聯(ADC)是另一個令人興奮的未來治療平臺,特定的抗體與細胞毒素相連接。隨著抗HER2 ADC的批準,臨床概念的證明已經實現,例如用于乳腺癌的恩美曲妥珠單抗(T-DM1)和Enhertu(DS8201),是曲妥珠單抗分別連接emtansine (一種細胞毒微管抑制劑)和deruxtecan (一種拓撲異構酶1抑制劑)。
1.Kinase drug discovery 20 years after imatinib: progress and future directions.
2.Epidermal growth factor receptor (EGFR) mutations in lung cancer: preclinical and clinical data.